Eu era pequena, mas me lembro como se fosse hoje.
Minha mãe guardava o óleo da batatinha frita, do bife à milanesa, do bolinho de chuva e no final do mês ele se transformava em sabão.
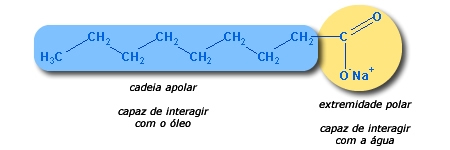
Lembrando disso, resolvi passar uma receita de sabão caseiro, que apesar de feio, limpa uma louça e uma panela como nenhum outro.
Aproveite.... recicle... não jogue o óleo de cozinha no ralo da pia.
INGREDIENTES:
4 L de óleo comestível usado
2 L de água
1/2 copo de sabão em pó
1 Kg de soda cáustica (NaOH)
10 mL de essência aromatizante (facultativo)
INSTRUÇÕES:
Dissolver o sabão em pó em ½ L de água quente
Dissolver a soda cáustica em 1½ L de água quente
Adicionar lentamente as duas soluções ao óleo
Mexer por 20 minutos
Adicionar a essência aromatizante
Despejar em formas
Desenformar no dia seguinte